Career Booster Nordamerika: Forschende in den USA und Kanada im Gespräch
Dr. Mascha Koenen an ihrem Schreibtisch mit Sicht auf den East River
© privat
(26.02.24) Die Deutsche Forschungsgemeinschaft (DFG) fördert mit dem Forschungsstipendium und seit 2019 mit dem Walter Benjamin-Stipendium die Grundsteinlegung für wissenschaftliche Karrieren durch Finanzierung eines eigenen, unabhängigen Forschungsvorhabens im Ausland und seit 2019 auch in Deutschland. Ein großer Teil dieser Stipendien wird in den USA und zu einem kleineren Teil auch in Kanada wahrgenommen. In einer Reihe von Gesprächen möchten wir Ihnen einen Eindruck von der Bandbreite der DFG-geförderten Wissenschaftlern vermitteln. In dieser Ausgabe schauen wir, wer sich hinter der Fördernummer KO 6368 verbirgt.
DFG: Liebe Frau Dr. Koenen, herzlichen Dank, dass Sie sich die Zeit für ein Gespräch mit dem Nordamerika-Büro nehmen. Sie sind derzeit an der Rockefeller University hier in New York City tätig, eine der wohl besten Adressen weltweit für Grundlagenforschung. Ist Ihnen eine Karriere als Forscherin bereits in die Wiege gelegt worden?
Mascha Koenen (MK): Den Dank für die Gelegenheit zu einem Gespräch würde ich gerne gleich erwidern und mich auch bei der DFG für die Förderung bedanken, die es mir erlaubt, hier in New York an einer der renommiertesten Universitäten des Landes zu forschen. Die Entscheidung für ein Studium der Biologie habe ich erst in der Oberstufe auf dem Gymnasium getroffen und sie hatte sehr viel mit meinem sehr engagierten Biologielehrer, Herrn Schmachtenberger, zu tun. Das Interesse für Natur und die Lebenswissenschaften allgemein ist mir allerdings tatsächlich, wie Sie sagen, auch schon in die Wiege gelegt worden. Meine Eltern haben beide Biologie studiert und mein Vater hat sich danach für eine wissenschaftliche Karriere als Neurobiologe am Max-Planck-Institut in Heidelberg entschieden. Als Kind waren meine ältere Schwester und ich daher auch immer wieder in Berührung mit Wissenschaft und durften ab und zu mal mit ins Institut kommen. Wir waren enorm fasziniert von den Laboren und den spannenden Experimenten. Bis heute tausche ich mich gerne mit meinen Eltern über meine Forschung aus.
Ein anderes wichtiges Gegenüber für wissenschaftliche Gespräche im privaten Umfeld habe ich in meinem Partner, mit dem ich seit dem Grundstudium vor 15 Jahren in Düsseldorf zusammen bin, gefunden. Wie in der Wissenschaft üblich, sind wir beide unseren unterschiedlichen Interessengebieten folgend während der Promotion in verschiedene Gegenden gezogen, die zu einer Fernbeziehung zwischen Davis in Kalifornien und Ulm führte. Nun sind wir beide wieder gemeinsam hier in New York an der Rockefeller University und würden auch sehr gerne die nächsten beruflichen Schritte gemeinsam unternehmen.

Bild des Rockefeller Campus mit Blick auf New York
© privat
DFG: Sie forschen an der Rockefeller University an einem Thema, das im Förderantrag mit „Die Rolle beiger Fettzellen für anabolen Knochenaufbau“ überschrieben ist. Ein Laie könnte hier wenigstens über zwei Dinge staunen, zum einen, dass es Fettzellen in unterschiedlichen Farben zu geben scheint, und zum anderen, dass Fettzellen etwas mit Knochenaufbau zu tun haben könnten.
MK: Es gibt tatsächlich zumindest drei verschiedene Farbnuancen in unserem Fettgewebe, die verschiedenen Arten von Fettzellen entsprechen. Das am besten bekannte Fettgewebe ist sicherlich das weiße Fett, das für die Speicherung von Energie in Form von Lipiden/Fetten zuständig ist und sich vor allem im Unterhautfettgewebe und in unserer Bauchhöhle anreichert. Braunes und beiges Fettgewebe, auch thermogenes Fettgewebe genannt, ist hingegen weniger bekannt. Im Gegensatz zum weißen Fett findet man es in kleineren Depots in unserem Schulter- und Nackenbereich, sowie entlang der oberen Wirbelsäule. Die verschiedenen Farbnuancen entstehen dabei durch die verschiedene Anzahl an Mitochondrien, die „Kraftwerke der Zellen“, die einen hohen Eisengehalt haben und daher ein bräunliches Erscheinungsbild ergeben. Das Besondere an thermogenen Fettzellen ist, dass sie einen Mechanismus in ihren Mitochondrien aktivieren können, der die Erzeugung von Wärme erlaubt. Diese Wärmeproduktion ist die wohl bekannteste Funktion des braunen und beigen Fettgewebes. Interessanterweise konnte erst vor circa 15 Jahren mit einer Vielzahl an wissenschaftlichen Publikationen gezeigt werden, das auch erwachsene Menschen thermogenes Fett besitzen, vorher dachte man, dass nur Babys mit diesem „Wärmekissen“ ausgestattet sind.
DFG: Wie unterscheiden sich funktional die braunen von den beigen Fettzellen?
MK: Der Unterschied zwischen braunen und beigen Fettzellen ist, dass beige Fettzellen in einem inaktiven Status den weißen Fettzellen zum Verwechseln ähnlich sehen und erst ihre Wärme produzierenden Aktivitäten aufnehmen, wenn sie stimuliert werden, z.B. durch Kälte. Braune Fettzellen zeigen hingegen eine basale thermogene Aktivität. Es ist noch nicht final geklärt, ob das thermogene Fettgewebe in erwachsenen Menschen eher dem braunen oder beigen Fettgewebe zugeordnet werden kann oder ob es sich um eine Mischung von beiden Zelltypen handelt. Durch ihr enormes Aktivierungspotential sind aber grade beige Fettzellen auf den ersten Blick für die Behandlung von Fettleibigkeit und Diabetes von Interesse, und darüber hinaus – und das ist mein Thema – potenziell auch für den Knochenaufbau. Unsere Knochen sind nämlich anders als viele Menschen denken, genau wie unser Fettgewebe ein sehr dynamisches „Organ“. Bei unserem Fettgewebe kann man sich das einfacher vorstellen, da wir alle wissen, wie es sich nach erhöhter Energiezufuhr und reduziertem Energieverbrauch, wie z.B. jetzt nach den Feiertagen, merklich ausdehnt. Wenn wir unseren Energieverbrauch steigern oder weniger Nahrung aufnehmen, schmelzen die Pölsterchen wieder. Unser Knochen funktioniert ähnlich dynamisch. Wenn wir in einer Wachstumsphase sind oder wenn wir unsere Knochen stärker mechanisch belasten, wird vermehrt Knochen aufgebaut durch die sogenannten Osteoblasten. Da unsere Knochenstruktur stetig erneuert werden muss, um stabil zu bleiben, muss auch immer „abgenutztes“ Material abgebaut und ersetzt werden. Die Aufgabe des Abbaus wird von den Osteoklasten vollbracht.
DFG: Wie dynamisch muss man sich das vorstellen, wie lange braucht es also, bis sich unser Skelett vollständig erneuert hat?
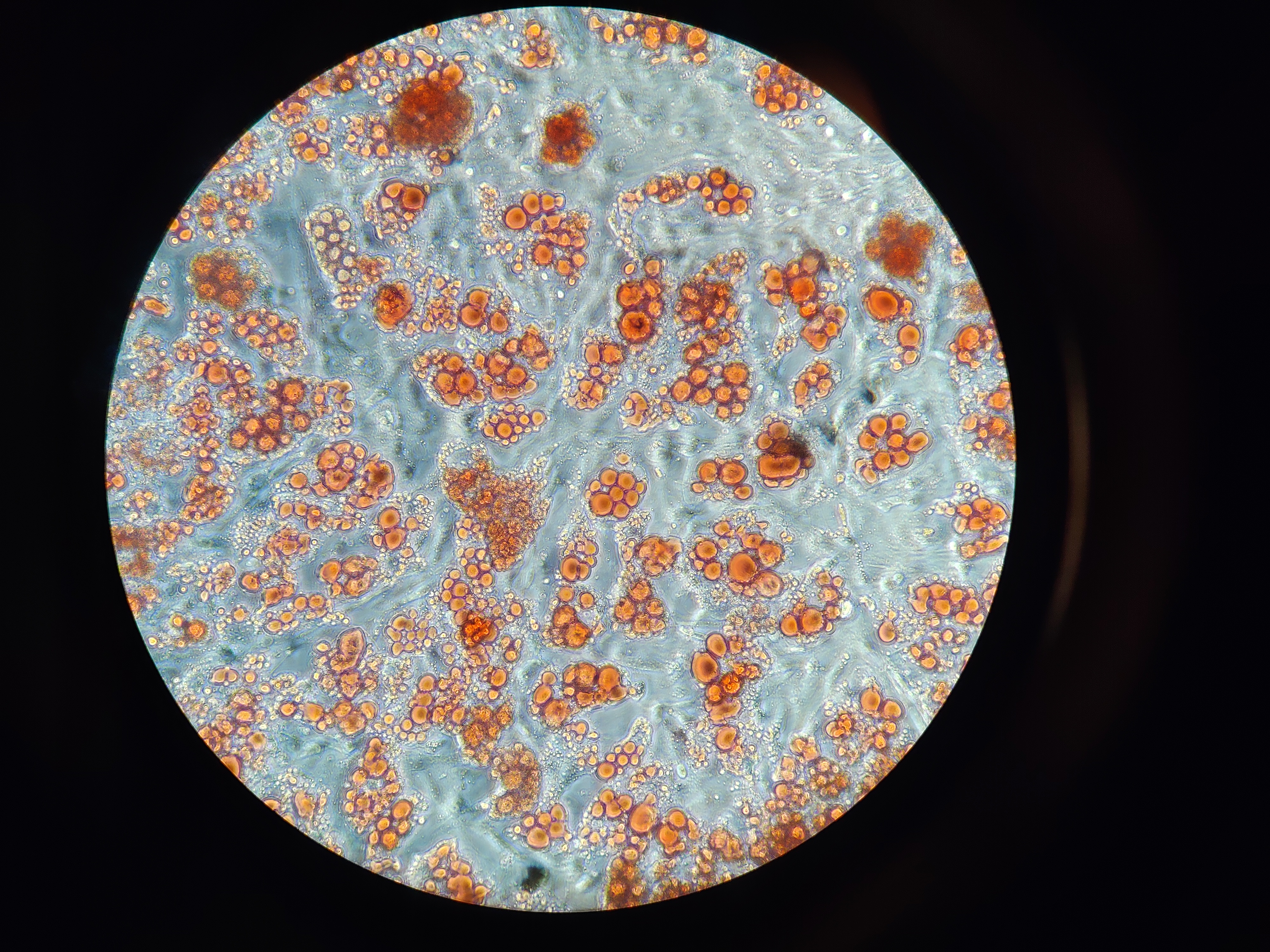
Fettzellen in Kultur, deren Fett mittels Oil-red-O Färbung rot angefärbt ist
© privat
MK: Das kommt ein bisschen auf den Knochentyp an. Sehr kompakte Knochen brauchen ca. 10 Jahre für die Erneuerung, wohingegen das „schwammartige“ Knochengewebe innerhalb der Wirbelkörper und Langknochen schon nach fünf Jahren erneuert ist. In einem ausgewachsenen gesunden Menschen sollten Knochenaufbau und Knochenabbau in Balance sein, im Alter oder durch erhöhte Immobilität verschiebt sich dieses Gleichgewicht hin zu einer erhöhten Osteoklasten- und einer verminderten Osteoblasten-Aktivität und destabilisiert so unsere Knochen, was sie anfälliger für Brüche werden lässt.
DFG: Der Sinn von Knochenaufbau ist leichter nachzuvollziehen als der Sinn des Abbaus von Knochen. Wofür brauchen wir das?
MK: Wenn Sie sich zum Beispiel den Heilungsprozess eines Knochenbruchs anschauen, kann man sich einfach vorstellen, dass das zerstörte Knochenmaterial erst einmal abgebaut werden muss, bevor der Knochen verheilen kann. Dies wird durch die Bildung eines sogenannten Kallus eingeleitet, bei dem nach einem ersten Entzündungsprozess neugebildetes Knochengewebe um die Bruchstelle herum entsteht. Dieser verknöcherte Kallus ist deutlich dicker als der ursprüngliche Knochen und das überschüssige Gewebe muss dann nach einer Weile wieder abgebaut werden. Insgesamt ist ein Zuviel an Knochen nicht gut, denn der Platz für das Knochenmark würde knapp und der Knochen wäre deutlich weniger biegsam. Nicht nur nach einem Bruch sind das Zusammenspiel von Knochenabbau und -aufbau fundamental für den Körper. Da unsere Knochen im Alltag ständig gebraucht und strapaziert werden, entsteht ein ganz normaler Verschleiß, durch den die Knochen abgenutzt werden. Um diese „Nutzspuren“ zu beseitigen, muss das alte Knochengewebe abgebaut werden, bevor es dann ersetzt werden kann.
DFG: Und wie kommen da Fettzellen ins Spiel?
MK: Wir wissen schon lange, dass weiße Fettzellen den Knochen in Tieren und Menschen beeinflussen können. Dies ist über verschiedenen Mechanismen möglich. Erstens entstehen weiße Adipozyten, also die Zellen des Fettgewebes, und die knochenaufbauenden Osteoblasten aus den gleichen Vorläuferzellen. Das bedeutet, dass sich eine Vorläuferzelle entweder in eine Fettzelle oder eine Knochenzelle umwandeln kann, es also entwicklungsbiologisch eine gewisse Balance zwischen den zwei Zelltypen gibt. Wenn nun diese Balance zugunsten der Fettzellen verschoben wird, wie es zum Beispiel durch Medikamente wie Cortisol passieren kann, wird im Gegenzug weniger Knochen gebildet.
Zweitens können bereits fertig ausgebildete Adipozyten und Knochenzellen miteinander kommunizieren und sich so gegenseitig in ihrer Funktion beeinflussen. Dies geschieht über Hormone und andere Signalmoleküle, die von den Zellen ins Blut abgegeben werden. Das erste dieser zahlreichen Moleküle, das von Adipozyten sekretierte Leptin, wurde bereits 1994 von Dr. Jeffrey Friedman, dem Doktorvater meines Arbeitsgruppenleiters, entdeckt. Dieser Kommunikationsweg ist besonders wichtig für die kleinen beigen Fettgewebedepots in Nacken und Schulterbereich, da eine vergleichsweise große Distanz zwischen diesen und den Knochen liegt. Interessanterweise produzieren die verschiedenen Fettgewebetypen unterschiedliche Signalmoleküle, von denen sich diese der braunen und beigen Fettdepots, anders als der schlechte Ruf des weißen Körperfettes eigentlich vermuten lässt, eher positiv auf die Gesundheit auswirken. Kleinere Studien haben gezeigt, dass Erwachsene mit größeren beigen Fettdepots häufig auch bessere Knochen haben. In meinem Forschungsprojekt untersuche ich diesen Zusammenhang und versuche herauszufinden, ob das beige Fettgewebe mit seinen Signalmolekülen den Knochen direkt beeinflusst und welche molekularen Funktionen dafür notwendig sind. Das Cohen Lab ist dabei ein exzellenter Ort für meine Forschung, da die Arbeitsgruppe führend auf diesem Gebiet ist. Neben der Grundlagenforschung hat die Gruppe durch Prof. Cohens Arbeit als Mediziner auch Anbindung an das Memorial Sloan Kettering Cancer Center und seine Patienten. Diese Anbindung an das MSK-Krankenhaus hat eine der wichtigsten, großangelegten Studien mit mehr als 50.000 Individuen zu thermogenem Fettgewebe in Menschen ermöglicht, die unsere Arbeitsgruppe zusammen mit Kollegen 2021 in Nature Medicine veröffentlicht hat.
Kulinarische Köstlichkeiten in einem koreanischen Restaurant in New York
© privat
DFG: Wenn so etwas von grundlegender Bedeutung erforscht wird, sollten solche Zusammenhänge nicht auch ein wichtiges Thema der Wissenschaftskommunikation sein?
MK: Definitiv. Ich denke das Thema berührt viele Menschen auch auf einer persönlichen Ebene, da Übergewicht und Osteoporose ja als sogenannte Volkskrankheiten viele Menschen direkt betreffen. Deshalb können wir auch schnell ein gewisses Interesse für unsere Forschung wecken. Die Menschen sind immer sehr überrascht, wenn ich ihnen über die positiven Eigenschaften von Fett erzähle, besonders, dass jeder recht einfach sein beiges Fettgewebe und dessen positive Eigenschaften trainieren kann. Beiges Fett kann nämlich durch Kälte aktiviert werden, um Wärme zu produzieren und eben auch die Signalmoleküle abzugeben, die ich erforsche.
In Zusammenarbeit mit dem Rockefeller University Research Hospital führen wir sogar Studien an freiwilligen Studienteilnehmern durch. Wir haben zum Beispiel eine Versuchsreihe laufen, in der Freiwillige eine gekühlte Weste anziehen und wir ihr Blutserum vor und nach der Kältebehandlung auf Signalmoleküle untersuchen. Diese Daten können wir dann mit unseren genetischen Mausmodellen und Zellkulturdaten abgleichen, um vielversprechende Kandidaten zu identifizieren, funktionell zu untersuchen, und hoffentlich eines Tages als Therapieansatz für Krankheiten, die mit dem Fett und Knochen zusammenhängen erforschen.
DFG: Wo sehen Sie weitere Vorteile eines DFG-geförderten Aufenthalts im Ausland, speziell hier in den USA und an der Rockefeller Universität?
MK: Es ist eine absolute Bereicherung, nicht nur wissenschaftlich, sondern auch gesellschaftlich die Möglichkeit zu bekommen, ein anderes Land und eine andere Wissenschaftskultur kennenlernen zu dürfen. Die USA sind natürlich ein großes Land, das sehr viele verschiedene Facetten bietet. Gerade New York ist eine ganz besondere Stadt, in der man jeden Tag etwas Neues erleben und Menschen aus aller Welt kennenlernen kann. Die Rockefeller University selbst bietet nicht nur hervorragende personelle und finanzielle Ausstattung mit einem Fokus auf Grundlagenforschung, vergleichbar mit den Max-Planck- oder Helmholtz-Instituten in Deutschland, sondern legt auch besonderen Wert auf den Department-unabhängigen Austausch von Wissenschaftlern untereinander und mit vielen der Top-Wissenschaftler aus der ganzen Welt. Hier habe ich gelernt, noch weiter über den Tellerrand zu schauen und mich bei meiner Arbeit durch andere Disziplinen inspirieren zu lassen. Das erlaubt mir, neue Methoden schneller zu erschließen, um generelle Prinzipien aufdecken zu können, die in verschiedensten wissenschaftlichen Fragestellungen eine Gültigkeit haben könnten. Das klassische „think big“ wird hier zu „think even bigger“ umgewandelt und diesen Mut, neueste Techniken zu nutzen und komplizierte Fragestellungen anzugehen, das ist etwas, was ich plane, auch in meiner Zukunft in der Wissenschaft weiter zu verfolgen.
Eine weitere interessante Erfahrung ist zu lernen, wie sich die in der Wissenschaft häufig notwendige und gern gesehene Mobilität auf das generelle Leben auswirkt. Ich hatte ja zu Beginn schon beschrieben, wie mein Partner und ich uns zu einer langjährigen Fernbeziehung über den Atlantik entschlossen hatten, um unseren speziellen Interessengebieten folgen zu können. Auch viele meiner Freunde, die ich während der Promotion in Ulm getroffen habe, kamen aus ganz verschiedenen Ländern mit sehr unterschiedlichen kulturellen Hintergründen. Schon damals habe ich diese Vielfalt als enorme Bereicherung erlebt. Diese Erfahrung selbst einmal als Gast in einem anderen Land zu leben, in dem man auf ein Visum angewiesen ist und nicht die eigene Muttersprache nutzen kann, lehrt einen noch viel mehr, sich mit den verschiedensten Menschen auseinanderzusetzen. Sich von Unterschieden also nicht abschrecken, sondern inspirieren zu lassen und gemeinsame Kompromisse zu finden.
DFG: Sie waren in Deutschland auch in der politischen Arbeit aktiv. Was waren da die Beweggründe?
MK: Ich glaube fest daran, dass es gut ist, sich nicht nur in der eigenen „Bubble“ zu bewegen, soll heißen, sich nicht nur mit anderen Wissenschaftlern auszutauschen, die seit meinem Studium einen Großteil meiner Freunde ausmachen. Ich bin zudem der Meinung, dass es wichtig ist, sich gesellschaftlich für ein vielfältiges Miteinander und gegen Ausgrenzung zu engagieren. Jetzt in den USA kann ich mich natürlich weniger einbringen, auch weil ich auf einem Nicht-Immigrationsvisum ein zeitlich begrenzter Gast bin. Es gibt hier aber exzellente Möglichkeiten, sich innerhalb der Universität zu engagieren, wie zum Beispiel zur besseren Vernetzung von internationalen Gastwissenschaftlern oder zur Förderung von Minderheiten in naturwissenschaftlichen Fächern.
In der Red Rock-Wüste in Nevada
© privat
DFG: Wie sehen Sie Ihre persönlichen Karriereperspektiven?
MK: Mein Ziel ist es, weiter in der Wissenschaft zu arbeiten und durch die Leitung einer eigenen Forschungsgruppe die Grundlagen von metabolischen Erkrankungen zu erforschen und auch in der Lehre an die nächste Generation von Wissenschaftlern weiterzugeben. Mein Fokus wird hierbei weiter auf der Kommunikation unterschiedlicher Zelltypen und zwischen Organen liegen, um komplexe Krankheitsprozesse verstehen zu können. Zeitlich gesehen versuche ich, bis Ende dieses Jahres mein Projekt abschließen zu können und mich dann gemeinsam mit meinem Partner in Deutschland und Europa um eine geeignete Anstellung zu bemühen. Wir sind beide optimistisch gestimmt, dass es in unserer modernen Gesellschaft eine Lösung für die Doppelkarriere-Frage geben wird, nicht mehr über neun Zeitzonen – wie seinerzeit zwischen Ulm und Kalifornien – sondern in derselben Region oder gar Stadt. Der Fokus wird hier aber wieder darauf liegen, eine Umgebung zu finden, in der man große wissenschaftliche Fragestellungen mit modernen technischen Möglichkeiten in einem kollaborativen Umfeld angehen kann, am liebsten in einem internationalen Umfeld. Denn eines muss man immer bedenken, Wissenschaft ist Teamarbeit und das gilt nicht nur für die eigene Arbeitsgruppe, sondern auch für den steten Austausch mit anderen Wissenschaftlern aus der ganzen Welt.
DFG: Sie arbeiten derzeit an Mausmodellen, also mit Tierversuchen. Ist das nicht eine besondere Herausforderung nach innen wie nach außen?
MK: Sie meinen mit „nach innen“, wie es mir dabei geht? Ja, sicher, als Wissenschaftler habe ich auch zuallererst einmal ein Interesse daran, das mit der Forschung verbundene Tierleid gegen den Erkenntnisgewinn abzuwiegen. Man kann aber leider nicht alles in der Zellkultur beobachten, denn Fettgewebe besteht in Wirklichkeit nur zu 50% aus Fettzellen und in der Petrischale haben Sie 100% Fettzellen. Die Anordnung der Zellen zueinander und die Interaktion mit Neuronen und Blutgefäßen lassen sich hier genauso wie komplexe Krankheitsprozesse, die mehrerer Organe betreffen, leider noch nicht abbilden. Natürlich verbessern sich die Methoden auch immer weiter und Möglichkeiten, Organe zu kultivieren oder auf einem „Chip“ nachzubauen, werden einfacher umzusetzen, allerdings benötigt man für diese Ersatzversuche ja auch zuerst Zellen oder Organe, die aus einem Tier gewonnen werden müssen. Hinzu kommt, dass wir an sogenannten Knock-out- und Knock-In-Mäusen forschen, also an Tieren, bei denen gezielt Gene ein- und ausgeschaltet werden können. Das müssen wir, und damit zu den Herausforderungen „nach außen“, in Anträgen gut begründen, die ethischen Prüfungen und damit auch den Erfordernissen der Wissenschaftskommunikation standhalten müssen. Wichtig ist es zu vermitteln, dass auch wir Wissenschaftler immer versuchen, Tierversuche zu reduzieren und wenn möglich durch alternative Techniken zu ersetzten.
DFG: Lassen Sie uns noch einmal auf mögliche Ergebnisse Ihrer Forschung zu sprechen kommen. Sie vermuten positive Auswirkungen von Kälte auf Herzgesundheit und Knochenbau. Muss ich wirklich morgens für zehn Minuten in die Eistonne?
MK: Es sollte zumindest bei einem gesunden Menschen nicht schaden, ist jedoch auch nicht nötig. Wichtig bei der Aktivierung des thermogenen Fettes ist, dass man sich nur zu einem gewissen Grad Kälte aussetzt, aber nur so weit, dass man nicht anfängt zu zittern. Denn wenn wir zittern, übernehmen unsere Muskeln statt des braunen Fettgewebes die Wärmeproduktion. Mit meiner Forschung gehe ich aber einen Schritt weiter und möchte die Signalmoleküle identifizieren, die von aktivierten thermogenen Fettzellen in die Blutbahn gegeben werden und dann den Knochenaufbau fördern. Wenn wir solche Moleküle identifizieren, könnte man andere Wege suchen, diese mittels Medikamente zu aktivieren. Bei meiner Arbeit geht es aber vor allem darum zu verstehen, wie Fettzellen funktionieren, wie und ob sie mit anderen Zellen kommunizieren und ob und wie Veränderungen dieser Vorgänge zu der Entstehung von Krankheitsprozessen beitragen. Wenn wir in der Lage sind, bestimmte Signalmoleküle zu identifizieren, können wir auch deren Wirkung auf andere Gewebe und Organe untersuchen. Mein Antrieb ist es, neue Prozesse und Interaktionen zu entdecken. Wenn wir das Glück haben, dass sich diese „for the benefit of humanity“ (das Rockefeller-Universitätsmotto) nutzen lassen, umso besser!
DFG: Hätten Sie denn einen praktischen Tipp aus dieser Rubrik, zum Beispiel, wie man sich Kälte aussetzen kann, ohne zu frieren?
MK: Wir untersuchen in unserem Labor tatsächlich, wie sich das „ice-water-dipping“ auf die allgemeine Gesundheit und das thermogene Fett auswirkt, und arbeiten dazu mit Freiwilligen aus Minnesota zusammen, die im Winter regelmäßig in zugefrorenen Seen schwimmen gehen. Für mich persönlich ist das aber auch etwas zu kalt. Am einfachsten ist es, seinen Körper immer mal wieder durch leichtes Kälteempfinden zu trainieren. Das muss nicht über lange Zeiträume passieren, aber wenn Sie beim Spazierengehen zum Beispiel statt einer Jacke eine Weste anziehen, erlauben Sie ihrem Körper, die Außentemperaturen besser wahrzunehmen. Eine andere Möglichkeit ist es, die basale Zimmertemperatur nicht ganz so warm einzustellen. Das ist vergleichbar mit unseren Experimenten an Mäusen, bei denen wir deren „Wohntemperatur“ reduzieren, aber nur soweit, dass sie noch nicht frieren – immer bedenken, wenn man friert und zittert, ist es zu viel des Guten, denn dann werden die Muskeln statt des thermogenen Fetts aktiviert.
DFG: Lieben Dank für diesen Tipp, das sehr unterhaltsame Gespräch und für die Einblicke in Ihre Forschung zu möglichen Zusammenhängen zwischen Fettstoffwechsel und Knochenbau. Wir wünschen Ihnen noch einen ertragreichen Aufenthalt hier in New York und für Sie und Ihren Partner alles Gute bei der Fortsetzung der wissenschaftlichen Karrieren hoffentlich in Deutschland.


